
中國企業報集團主管主辦
中國企業信息交流平臺
近日,泛生子注冊的"人PDGFRA基因D842V突變檢測試劑盒"(以下簡稱"試劑盒")獲國家藥品監督管理局(NMPA)批準,成為中國伴隨診斷試劑指導原則出臺后NMPA批準的首個以橋接路徑開發的伴隨診斷試劑盒。該試劑盒由泛生子與基石藥業聯合開發,可通過檢測胃腸間質瘤(GIST)患者的PDGFRA基因突變,用于泰吉華?(通用名:阿伐替尼)藥物的伴隨診斷。
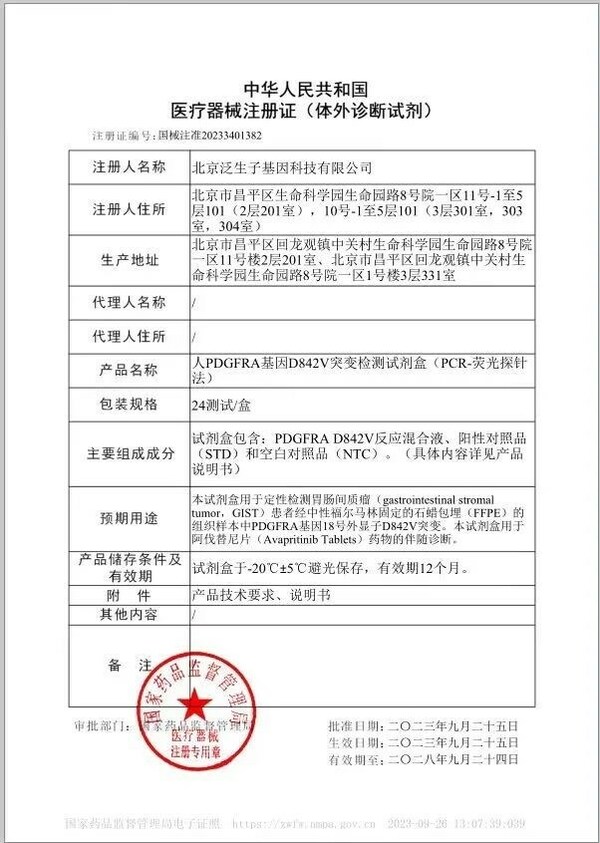
該試劑盒的上市,還實現了多項"首個":首個結合中國境內外藥效數據批準上市的國產伴隨診斷試劑盒;首個在《抗腫瘤藥物的非原研伴隨診斷試劑臨床試驗注冊審查指導原則》和《與抗腫瘤藥物同步研發的原研伴隨診斷試劑臨床試驗注冊審查指導原則》出臺后以完整橋接路徑上市的伴隨試劑盒;首個藥物和器械均獲得NMPA優先審評的伴隨試劑盒。
PDGFRA基因D842V突變的GIST患者一直缺乏有效治療藥物,而泰吉華?在PDGFRA基因外顯子18突變(包括D842V突變)的不可切除性或轉移性GIST中國患者中表現出優異的抗腫瘤活性,且安全性和耐受性良好,是中國首個獲批用于治療該疾病精準治療的藥物。該伴隨診斷試劑盒是國內首個針對人PDGFRA基因D842V突變的試劑盒,以科學有效的臨床數據作支撐,更精準的篩選出患者,匹配泰吉華?進行治療,使患者得到更精準、更大的生存獲益。
該試劑盒審批的整個流程數據充分、嚴謹,最終實現三年內審批落地。對此,泛生子聯合創始人、董事長及CEO王思振表示:"本著為患者負責的態度,泛生子與基石藥業秉持著同樣嚴格的品質、效率標準。我們可為藥企客戶提供高效的伴隨診斷服務,助力縮短藥物研發周期,促進高效獲批。在與合作伙伴聯手推進創新產品的報證及應用過程中,我們更希望攜手推動行業更規范,更標準,讓合規的精準醫療惠及更多患者。"
基石藥業首席科學官謝毅釗博士表示:"精準醫療是基石藥業的核心策略之一。泰吉華?伴隨診斷試劑盒的獲批展示了我們在中國精準醫療伴隨診斷開發方面的能力。此案例的成功歸功于基石藥業和我們經驗豐富的診斷合作伙伴泛生子,以及Blueprint Medicines的共同努力。相信此伴隨診斷試劑盒的獲批和商業化,會使更多中國GIST患者從泰吉華?的治療中獲益。"
相關稿件